
LE REAZIONI NUCLEARI
I PRICIPI DELLE REAZIONI NUCLEARI
L'atomo è composto da protoni, che hanno carica positiva, e da neutroni, che non hanno carica elettrica. Queste particelle formano il nucleo dell'atomo, mentre gli elettroni, che hanno carica negativa, ruotano attorno al nucleo in orbite definite.Il numero atomico Z rappresenta il numero di protoni (elettroni) presenti in un atomo di un determinato elemento. Ogni elemento chimico ha un numero atomico unico che lo identifica e determina la sua posizione nella tavola periodica degli elementi.Il numero di massa A rappresenta la somma dei protoni e dei neutroni presenti nel nucleo di un atomo. Questo numero indica il numero totale di nucleoni all'interno del nucleo.Prendiamo come esempio l'elio (He), che ha due protoni, due elettroni e due neutroni. Il numero atomico Z per l'elio è 2, poiché ha due protoni ed elettroni. Il numero di massa A per l'elio è 4, poiché la somma dei protoni e dei neutroni nel nucleo è 4.In fisica, un elemento K con numero atomico Z e numero di massa A viene rappresentato come K(A, Z), dove A è il numero di massa e Z è il numero atomico. Questa notazione è utile per identificare in modo univoco gli isotopi di un elemento, che hanno lo stesso numero atomico ma differiscono per il numero di neutroni nel nucleo.
Tavola periodica degli elementi
GLI ISOTOPI
Gli isotopi sono varianti di un elemento chimico che hanno lo stesso numero atomico (stesso numero di protoni) ma diverso numero di massa (numero di protoni più neutroni nel nucleo).In altre parole, gli isotopi di un elemento hanno lo stesso numero di elettroni e protoni, ma differiscono per il numero di neutroni nel nucleo.Gli isotopi sono importanti nelle reazioni nucleari perché diversi isotopi di un elemento possono comportarsi in modo diverso durante una reazione nucleare.Alcuni isotopi possono essere instabili e sottoporsi a decadimento radioattivo, emettendo radiazioni e trasformandosi in un isotopo diverso o in un elemento completamente diverso.Non tutti gli isotopi sono presenti in natura. Alcuni isotopi sono stabili e si trovano comunemente negli elementi naturali, mentre altri isotopi sono instabili e si decompongono nel tempo.Tuttavia, alcuni isotopi possono essere creati in laboratorio utilizzando tecniche speciali come l'uso di laser, acceleratori di particelle o metodi elettromagnetici.Per esempio, l'idrogeno (H) ha un isotopo chiamato deuterio (D) che ha un protone, un elettrone e un neutrone nel nucleo.Il deuterio ha numero atomico Z=1 e numero di massa A=2. Un altro isotopo dell'idrogeno è il trizio (T), che ha un protone, un elettrone e due neutroni nel nucleo. Il trizio ha numero atomico Z=1 e numero di massa A=3.Gli isotopi hanno diverse proprietà e possono essere utilizzati in diverse applicazioni scientifiche e tecnologiche.Ad esempio, il deuterio è utilizzato come combustibile nei reattori a fusione nucleare, mentre il trizio viene utilizzato nei dispositivi di produzione di energia nucleare e nelle armi nucleari.
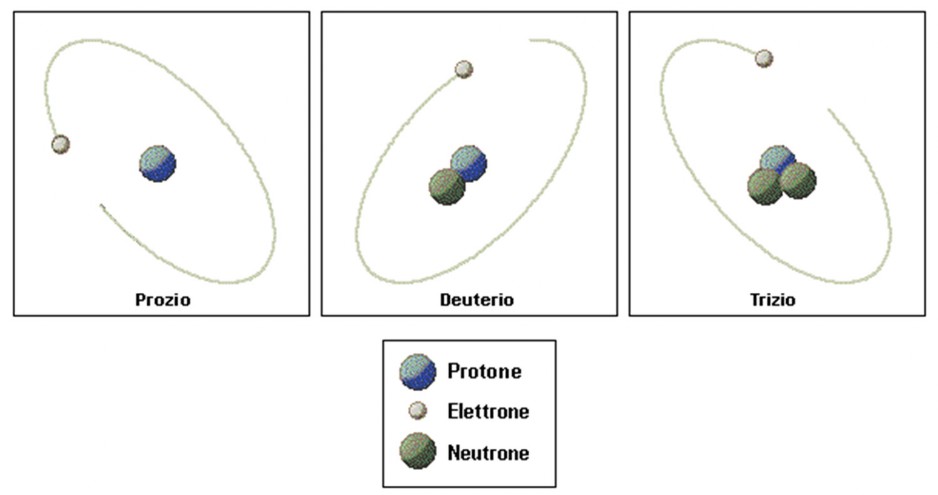
Gli isotopi dell’idrogeno
L’ENERGIA DI LEGAME
Consideriamo il nucleo di un atomo di deuterio, il quale possiede un protone e un neutrone.La massa del deuterio è leggermente inferiore alla somma delle masse di un protone e un neutrone.Questa differenza di massa è nota come "difetto di massa" e può essere spiegata utilizzando la formula di Einstein E=mc², che collega l'energia (E) alla massa (m) moltiplicata per il quadrato della velocità della luce (c²).Secondo la formula di Einstein, l'energia può essere convertita in massa e viceversa.Nella formazione del deuterio, la differenza di massa mancante viene convertita in energia, che viene dispersa nell'ambiente.L'energia liberata corrisponde all'energia di legame del nucleo, che rappresenta l'energia necessaria per separare i nucleoni (protoni e neutroni) nel nucleo.La massa mancante nel nucleo del deuterio corrisponde a un difetto di massa di 0,0039 x 10⁻²⁷ Kg.Applicando la formula E=mc², possiamo calcolare l'energia associata a questa massa mancante.Otteniamo un valore di energia di 2,22 MeV (milioni di electronvolt). L'eV (electronvolt) è un'unità di misura comune per l'energia delle particelle subatomiche.L'energia di legame del nucleo è l'energia che viene rilasciata o assorbita durante le reazioni nucleari.Le reazioni nucleari coinvolgono cambiamenti nell'arrangiamento dei nucleoni nei nuclei atomici, e durante questi processi viene liberata o assorbita energia.Questa energia è ciò che permette il funzionamento delle reazioni nucleari e può essere sfruttata per scopi energetici o in applicazioni tecnologiche.Nelle reazioni nucleari, la massa viene convertita in energia secondo la famosa equazione di Einstein.Questo è un principio fondamentale che governa il funzionamento delle reazioni nucleari e la produzione di energia nel contesto nucleare.
